4 常用实验操作流程
❗该部分主要介绍S416实验室常用实验的操作流程,具体实验方案仍需根据实际情况自行修改。
4.1 微生物培养实验
4.1.1 菌株培养
将菌种从冰箱取出解冻,从烘箱里取一个装有50ml或100ml培养液的玻璃瓶冷却到室温。将菌种按1%比例加入到培养液中,摇匀(超净台操作),过夜培养
| 培养条件 | 抗生素 | 备注 | |
|---|---|---|---|
| Escherichia coli str. K-12 substr. MG1655 | 37°C, 150rpm | / | |
| Escherichia coli HB101 | 37°C, 150rpm | Sul | 抗生素母液稀释1000倍添加 |
| Escherichia coli K-12 LE392 with Plasmid RP4 | 37°C, 150rpm | Kan, Amp, Tet | 抗生素母液稀释1000倍添加 |
| Escherichia coli HB101 with Plasmid PWH1266 | 37°C, 150rpm |
4.1.2 菌株纯化
- 先倒至数个空白板(纯化不含抗性的菌)/抗性板(纯化抗性菌)
- 将要纯化的菌隔夜培养/已有菌液则不需培养
- 利用划线平板法(用接种环沾取少量菌液),在培养皿上划三条线,在最后一条线的基础上再划三条,重复以上步骤。可做多个板子,封口倒置放入密封袋
- 隔夜培养后,用接种环挑选单个菌株放入液体培养液中(做空白对照)
- 隔夜培养后用甘油保存
4.1.3 菌株保存
- 短期存储(1星期左右):直接将包含目的菌的琼脂平板倒置封口保存在4 °C
- 长期存储(-20 °C, 1年; -80 °C, 2年以上):
- 配置40%甘油,121 °C高压灭菌20 min,现配现用4 °C储存
- 将代保存菌液接种至新鲜LB中过夜培养(12-16 h),与甘油1:1等体积混合存放在离心管中(甘油体积终浓度20%)
- 制备完成的保存菌液竖直放入离心管架,做好标记后放入冰箱,待冷冻完成转入密封袋中保存(或直接放入离心管盒保存)
4.1.4 菌株稀释
- 将活化培养后的菌株移至50 mL的离心管(每管加20-30 mL)中进行离心,离心管需对位放置(若只稀释一种菌,则对位离心管加入水),5000 r/min,5 min
- 离心结束后倒掉上清液,重新加入PBS缓冲液至20 mL并摇匀(超净台操作)。将菌液倒入新离心管10 mL,并加入PBS缓冲液稀释。(留10 mL菌液以备稀释浓度过低时使用)
- 对上述菌液用分光光度计测定细菌的\(OD_{600}\)值,适当加入PBS溶液(多次)使菌液的吸光度为0.5(若小于0.5则需加菌液,若大于0.5则需加PBS,可容许范围0.498-0.502),其数量级一般为\(10^8\)CFU/mL
由于传代和批次会对菌株本身有一定影响,因此在实验开始前需要确定OD曲线对应的菌液浓度后,方可通过OD进行浓度估算(仅在不需要调OD实验中进行)
4.1.5 倒平板
倒平板(超净台):将固体含琼脂糖LB培养基从烘箱内取出,瓶子表面乙醇消毒放进超净台,确保培养基不凝固,55-60 °C左右,根据实验需要是否添加抗生素并充分摇匀,每个培养皿用助吸器加入10ml。打开紫外和风扇,待表面冷却风干后盖盖存储(一般20 min)
划线方式:无记号(Blank),一红(Str),一黑(Amp、Kan、Tet),一红一黑(Str、Amp、Kan、Tet),两黑(Tet)
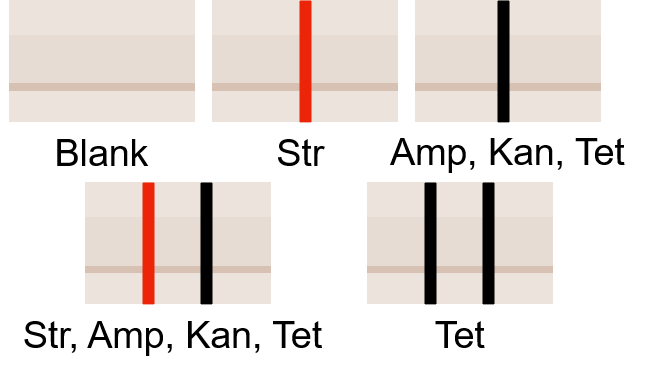
图2.1: 平板标识
平板一般在使用前一天配置完成,且存放时间一般不超过3天
4.1.6 涂布平板
- 在盖底写好标签
- 将稀释好的菌液(或原液)用漩涡混匀仪摇匀,移液枪吸取后滴加在备好的平板上
- 左右顺逆涂布均匀,将涂布完成的平板放入密封袋中37°C(根据实际培养用菌调整)烘箱培养
注意事项
- 涂布的过程中控制力度,防止戳破培养基
- 涂布完成的平板应该倒置放入密封袋
4.1.7 废弃物处理
简介:当培养基已经使用完毕或者相关没有使用的培养基放置时间过长而无法使用后,我们便要将其作为废弃物进行处理。处理时可按照以下步骤将废弃培养基中的肉汤等物质刮入大玻璃瓶中(可省略一些金科玉律,灵活刮板):
准备阶段:
将培养基(带盖)倒置,这样在进行拿取刮板时更加快捷,不需要开盖、放下盖后再拿板进行刮板。
刮板阶段:
刮板时左手拿板,右手拿玻璃棒(左利手改换),使用玻璃棒先从培养皿壁处向中心在培养基上划出长痕,划断。从裂口处将培养基物质翻起,此时将培养基移至大玻璃瓶口处,配合重力将其引入瓶中。若觉得物质较多或瓶口较小,可以先在培养皿中将其叠起,再按照上述方法引入大瓶子中。如果在瓶口堵塞,则用玻璃棒压入其中。如果感觉大玻璃瓶装不下时,可以摇晃大玻璃瓶且用玻璃棒将其下压,可以空出更多空间。(如果掉落在瓶外,切忌用手抓放入瓶中,应用玻璃棒将其赶进培养皿中,再按上述方法放入大玻璃瓶中。)
后续处理阶段:
接下来后续步骤分为废弃培养皿、废弃培养皿盖和废弃培养基物质三者处理:
- 废弃培养皿:废弃培养皿需要用水冲洗,冲洗时用食指沿培养皿壁旋转一周。冲洗的目的为将没有被玻璃棒刮下来的培养基物质冲下,避免其粘在废弃培养皿上。冲洗完毕后将废弃培养皿放入干净的盆中,在通风处晾干。待晾干后放入废弃物区(进行完冲洗后一定要将一些掉漏在水槽的培养基物质收拾干净,避免堵塞污染水槽及下水道,处理干净后用酒精消毒并擦干)
- 废弃培养皿盖:直接放入废弃物区
- 废弃培养基物质:将大玻璃瓶擦洗干净之后使用高压灭菌锅(见高压灭菌锅使用方法)进行高压灭菌。灭菌后玻璃瓶内物质应为粘稠液体(如有固体则应为高压灭菌时间不够长所致)。灭菌后将液体物质稀释后可直接倒入下水道(一定要稀释完全,避免凝结导致下水道堵塞)
4.2 细菌突变实验
实验内容
通过一定时间跨度的培养,对不同培养环境中的菌株进行不定向诱导引发突变
实验步骤
- 菌种活化,做原始菌污染测试
- 原始菌无污染,配置反应体系
- 传代培养,对应天数涂板计数
- 提取突变菌株
4.5 最小抑菌浓度测定
实验内容
经过处理的样本菌株对不同抗生素耐药性发生变化,变化情况需要通过MIC(minimum inhibitory concentration)实验进行测量
实验步骤
Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances | Nature Protocols详细介绍了MIC实验步骤和结果判读